תיוניל כלוריד
| תיוניל כלוריד | ||
|---|---|---|
 | ||
| מבנה כימי של תיוניל כלוריד | ||
 | ||
| בקבוק המכיל כ-25 מ"ל של תיוניל כלוריד | ||
| שם סיסטמטי | Sulfurous dichloride | |
| נוסחה כימית | SOCl2 | |
| מסה מולרית | 118.97 | |
| מראה | נוזל שקוף | |
| צפיפות | 1.638 | |
| מצב צבירה | נוזל | |
| מסיסות | מגיב עם מים וממסים פרוטים אחרים | |
| ממסים | מסיס היטב במרבית הממסים האורגנים האפרוטיים (טולואן, כלורופורם, די-אתיל אתר) | |
| טמפרטורת היתוך | −104.5 | |
| טמפרטורת רתיחה | 74.6 | |
| מקדם שבירה | 1.517 (20 °C) | |
תיוניל כלוריד (אנגלית: Thionyl chloride) הוא תרכובות אי-אורגנית בעלת הנוסחה הכימית (SOCl2). זהו נוזל נדיף חסר צבע בעל ריח חריף מאד ( לעיתים נראה בגווני צהוב, בשל אי ניקיונות של גופרית או כלור מומסים).
תיוניל כלוריד הוא חומר רעיל ביותר ובעל תכונות שיתוך חזקות. במגע עם מים הוא משחרר גזים רעילים כמו חומצת מימן כלורי וגופרית דו-חמצנית.
תיוניל כלוריד הוא חומר גלם חשוב בייצור של חומרי לחימה כימיים קטלניים כגון: גזי-עצבים, כדוגמת VX.
ייצור
הייצור של תיוניל כלוריד, מבוסס על הגבה של גופרית תלת-חמצנית (SO3) עם גופרית דו-כלורית (SCl2), תוך פליטה של גז גופרית דו-חמצנית (SO2):
SO3 + SCl2 → SOCl2 + SO2
שימושים
לתיוניל כלוריד שימושים רבים בתחומי הכימיה, בדגש על תעשיית התרופות, שם הוא משמש כמגיב שמסוגל להמיר קבוצות הידרוקסיל (OH) של כהלים וחומצות קרבוקסיליות לאטום הכלור.
כמו כן, הוא משמש גם כתוסף חשוב באלקטרוליטים של סוללות (כמו סוללת ליתיום תיוניל-כלוריד), והוא משמש גם כחומר מייבש של הידראטים.
כמגיב בסינתזה אורגנית
תיוניל כלוריד הוא מגיב נפוץ מאד בסינתזה אורגנית, בין היתר בגלל קינטיקת התגובה המהירה והניצולת הגבוהה של תהליך ההתמרה. הניצולות מושגת תודות לפליטת תוצרי הלוואי כגזים (SO2) שמבעבעים מהתמיסה ובכך מסיטים את שיווי המשקל חזק לכיוון התוצר (עקרון לה-שטלייה).
מנגנון ההתמרה של קבוצת כוהל בקבוצת כלור על ידי תיוניל כלוריד:
בתגובה הכללית, הגיב כהל עם תיוניל כלוריד, לתת אלקיל כלוריד, גופרית דו-חמצנית וחומצת מימן כלורי.
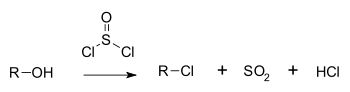
דוגמה למנגנון מפורט (הפעלה של חומצה קרבוקסילית, על ידי הפיכתה לאציל כלוריד):
תיוניל כלוריד משמש כמגיב בהכנת אציל כלוריד (הצורה המופעלת של חומצה קרבוקסילית)

תרשים סינתזות עבור תיוניל כלוריד
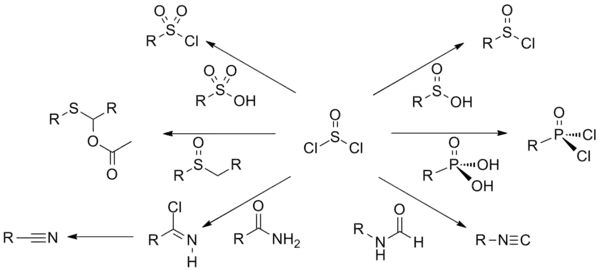
מגיבים חלופיים לתיוניל כלוריד
ניתן להשיג את הפעולה שמבצע התיוניל כלוריד גם עם מגיבים אחרים, לדוגמה:
- התמרה בקטליזה חומצית עם חומצת מימן כלורי (בתהליך זה, קבוצת ההידרוקסיל עוברת פרוטונציה על ידי החומצה ובכך היא נהפכת לקבוצה עוזבת טובה. בהמשך יון הכלוריד מבצע התקפה נוקלאופילית על הפחמן שקשור לקבוצה העוזבת, ומעזיב אותה). החיסרון: עשוי להשפיע על קבוצות אחרות שרגישות לתנאים חומציים.
- שימוש בזרחן חמש-כלורי (PCl5) או בזרחן שלוש-כלורי (PCl3) – פועל בדומה לתיוניל כלוריד. תוצר הלוואי שמשתחרר הוא גז פוספין (PH3) או (POCl3) – תלוי בממס בו התגובה מתרחשת.
קישורים חיצוניים
![]()

רישיון cc-by-sa 3.0
