נתרן אצטט
| נתרן אצטט (sodium acetate) | ||
|---|---|---|
 | ||
| שם סיסטמטי | סודיום אתאנואט (sodium ethanoate) | |
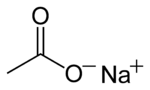
| נוסחה כימית | CH3COONa | |
| מסה מולרית | 82.03 (יבש), 136.08 (טרי-הידראט) | |
| מראה | אבקה לבנה | |
| מספר CAS | 127-09-3 (יבש), 6131-90-4 (טרי-הידראט) | |
| צפיפות | 1.45 (מוצק) | |
| מצב צבירה | מוצק | |
| מסיסות | 76 גרם ל-100 מ"ל | |
| טמפרטורת היתוך | 324 | |
| בסיסיות | 9.25 | |
| הערה כללית | מתפרק בחימום | |
נתרן אצטט (סודיום אצטט או סודיום אתאנואט) הוא מלח הנתרן של חומצה אצטית (חומצת חומץ). זהו חומר המופק בכמויות מסחריות למגוון רחב של שימושים.
יישומים
סודיום אצטט משמש בתעשיית הטקסטיל לניטרול שפכי חומצה גופרתית, וכפוטורזיסט כאשר משתמשים בדיו מבוסס אנילין. סודיום אצטט משמש גם כמחמיץ בעיבוד כרום, ומסייע לעכב את תהליך הגיפור של כלורופן בייצור גומי סינתטי.
סודיום אצטט משמש כחומר משמר במוצרי מזון, בהם הוא מסומן בדרך כלל כ-E262, תחת השם "סודיום דיאצטט".

סודיום אצטט הוא הבסיס המצומד של חומצה חלשה (חומצה אצטית), ולכן ניתן להשתמש בתמיסה של סודיום אצטט וחומצה אצטית כבופר, לשמירה על רמת חומציות קבועה יחסית. בופרים משמשים במגוון יישומים, בין השאר לתגובות ביוכימיות, הרגישות מאד לרמת החומציות. סודיום אצטט משמש גם בכריות חימום, למטרות שונות, ביניהן חימום מזון במנות קרב. גבישי סודיום אצטט טרי-הידראט (נקודת היתוך = 58 מעלות צלזיוס) מחוממים לכ-100 מעלות וניתכים. כאשר החומר מתקרר, מתקבלת תמיסה על-רוויה של סודיום אצטט במים.

תמיסה זו מסוגלת לעבור קירור יתר לטמפרטורת החדר, הרבה מתחת לטמפרטורת הקיפאון הרגילה של החומר, ללא יצירת גבישים. בכריות החימום מותקנת דיסקת מתכת, והקשה עליה יוצרת מרכז התגרענות, המתחיל את תגובת ההתגבשות לסודיום אצטט טרי-הידראט גבישי. תהליך יצירת הגבישים הינו אקסותרמי (פולט אנרגיה), ולכן נפלט חום.[1] [2][3]
בחימום לכ 400°C החומר מתפרק, תוצרי הפירוק הם בעיקר מתאן, פחמן דו-חמצני נתרן חמצני (Na2O) ופחמן, פירוליזה בנוכחות נתרן הידרוקסיד נותנת מתאן ונתרן קרבונט
ייצור
סודיום אצטט זול לייצור, ולכן בדרך כלל נרכש מספקי כימיקלים, ולא מיוצר במעבדה. ניתן ליצרו במעבדה בקלות, על ידי תגובה בין חומצה אצטית לבסיס נתרן כלשהו, כמו סודיום קרבונט, נתרן הידרוקסידי, ועוד.
CH3–COOH + Na+[HCO3]– → CH3–COO– Na+ + H2O + CO2
זו התגובה המתרחשת בניסוי הביתי המוכר, בו מערבבים חומץ וסודה לשתייה. על ידי אידוי המים, ניתן לקבל תמיסה מרוכזת של סודיום אצטט, או גבישים יבשים.
קישורים חיצוניים
![]()
- סרטון בנושא, באתר יוטיוב
הערות שוליים
- ↑ "Crystallization of Supersaturated Sodium Acetate". Journal of Chemical Education.
- ↑ "Fake" latent heat and supersaturation
- ↑ "How do sodium acetate heat pads work?". HowStuffWorks. בדיקה אחרונה ב-3 בספטמבר 2007.
- ↑ Serban C. Moldoveanu, Pyrolysis of Organic Molecules: Applications to Health and Environmental Issues, Elsevier, 2009, עמ' 519

רישיון cc-by-sa 3.0